 Lezione 2: gli orbitali atomici.
Lezione 2: gli orbitali atomici.
Come già detto nella lezione 1 gli orbitali atomici rappresentano, molto semplicisticamente, i risultati finali dell’equazione d’onda di Schrödinger e sono la rappresentazione grafica dello spazio in cui si ha la probabilità del 90% di trovare un determinato elettrone. La funzione d’onda orbitale, o orbitale, ci permette di descrivere lo stato quantico dell’elettrone ovvero la sua energia e la sua localizzazione nello spazio.
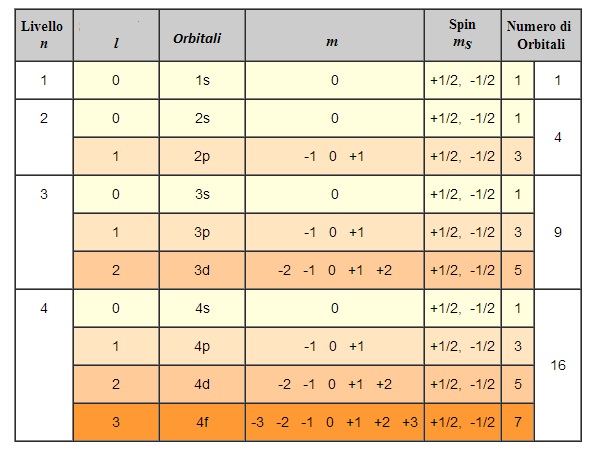
Lo stato energetico, la forma e l’orientamento nello spazio degli orbitali è definito da una serie di numeri chiamati numeri quantici: n, l, m ed ms.
- Il primo numero quantico n, detto anche principale, determina l’energia dell’orbitale e può assumere solo valori interi positivi, quindi 1, 2, 3 etc. All’aumentare di n aumenta l’energia dell’orbitale e la sua distanza dal nucleo. Ciò significa che l’energia non può assumere qualsiasi valore ma solo quelli definiti da n,quindi si parla di l’energia quantizzata.
- Il secondo numero quantico l, detto azimutale, definisce la forma dell’orbitale. E’ legato al numero quantico principale n in quanto può assumere tutti i valori compresi tra 0 e n-1. I diversi valori che l può assumere non sono altro che il numero dei sottolivelli possibili per i vari livelli, e sono indicati con le lettere s, p, d, f (dopo di questi si prosegue in ordine alfabetico g, h etc) per ricordare la terminologia usata dagli spettroscopisti per distinguere le righe spettrali: sottile, principale, diffusa, fondamentale.
- Il terzo numero quantico m, detto magnetico, stabilisce l’orientazione nello spazio dell’obritale. È collegato a l in quanto può assumere tutti i valori compresi tra –l e +l; stabilisce anche quanti orbitari spettano ai singoli livelli.
- Il quarto numero quantico ms, detto di spin, attribuisce all’elettrone un momento angolare intrinseco e può assumere soltanto due valori +1/2 e -1/2.
Il numero degli orbitali possibili è uguale a n2 mentre il numero degli elettroni che si possono trovare in ogni livello è uguale a 2n2.
E’ bene specificare che in ogni orbitale possono trovarsi al massimo due elettroni che avranno gli stessi numeri quantici tranne che per quello di spin; un elettrone avrà ms = +1/2 e l’altro ms = -1/2
Gli elettroni che occupano lo stesso orbitale sono necessariamente molto vicini e la loro coabitazione è possibile proprio perché hanno spin opposto.
Immaginateli come due piccoli magneti: se i poli sono opposti si attraggono se sono uguali si respingono, così gli spin.
A questo punto un esempio è d’uopo.
Se n=1 avremo che gli orbitali possibili saranno pari a n2 = 1, quindi un solo orbitale. Gli elettroni saranno 2n2 = 2
Sappiamo che 0< l < n-1
In questo caso dato che n = 1
l =0 quindi avremo un unico sottolivello chiamato 1s
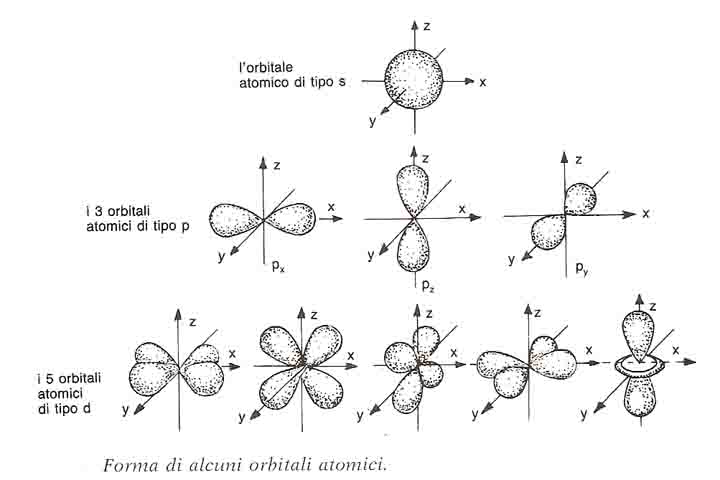
Sappiamo inoltre che –l < m < +l ma l = 0 quindi anche m = 0 pertanto il sottolivello s sarà formato da un unico orbitale (di forma sferica ad una distanza ben precisa dal nucleo, vedi immagine).
I due elettroni si troveranno all’interno dell’orbitale 1s con spin opposto.
Un altro esempio un po’ più complicato; al secondo livello energetico n = 2
n° orbitali possibili = n2 = 4
n° elettroni =2n2 = 8
l = 0, 1
Per cui al secondo livello energetico avremo:
-un sottolivello s, con un unico orbitale chiamato 2s, quando l = 0 ed m = 0
-un sottolivello p, con tre orbitali chiamati 2p quando l = 1 ed m = -1, 0,+1.
Gli orbitali 2p si dicono degeneri perché differiscono solo per il terzo numero quantico e sono sistemati su assi spaziali diversi (px, py,pz vedi immagine).In ognuno di questi orbitali si troveranno due elettroni con spin opposto per un totale di 8.
La tabella seguente mostrerà gli orbitali possibili per i vari livelli energetici.
Se volete essere sempre aggiornati su tutto ciò che concerne il blog basta un “mi piace” alla fanpage. Vi aspetto numerosi!
[banner]
immagine: http://www.marconi-galletti.it