Lezione 3: la configurazione elettronica–Gli elementi differiscono tra loro perché i loro atomi hanno una diversa struttura che dipende dal diverso numero di elettroni dislocati negli orbitali atomici. L’atomo nel complesso è neutro quindi presenta un ugual numero di elettroni e protoni. Alla “costruzione” dell’atomo, o più specificatamente del nucleo, partecipano anche i neutroni che hanno massa uguale ai protoni ma non hanno carica elettrica. Nella chimica è importantissimo sapere come sono sistemati gli elettroni perché le reazioni chimiche coinvolgono la parte più esterna dell’atomo, ovvero gli elettroni.
In questa lezione cercherò di far comprendere come costruire la configurazione elettronica.
Bisogna tener presente e rispettare tre principi:
-Il principio di Aufbau
-Il principio di esclusione di Pauli
-Il principio della massima molteplicità o regola di Hund
1) Il principio di Aufbau, dal tedesco costruzione, afferma che la struttura elettronica dello stato fondamentale (quindi non eccitato) corrisponde a quella che si otterrebbe nel caso in cui tutti gli elettroni venissero allontanati dall’atomo per poi venire reintrodotti ad uno ad uno negli orbitali disponibili, occupandoli seguendo l’ordine di energia crescente.
2) Il principio di esclusione di Pauli, dal nome del fisico austriaco, afferma che due elettroni in un atomo non potranno mai avere tutti i numeri quantici uguali, di conseguenza in un singolo orbitale non potranno mai trovarsi più di due elettroni.
3) La regola di Hund, dal nome del fisico tedesco, afferma che gli elettroni si dispongono prima singolarmente negli orbitali con lo stesso contenuto energetico (orbitali degeneri liberi) e solo quando non ci sono altri, accettano di accoppiarsi.
Detti così questi principi sembrano campati in aria quindi faccio un paio di esempi.
Prima di tutto bisogna sapere qual è la scala d’energia degli orbitali la figura seguente sarà molto esplicativa.
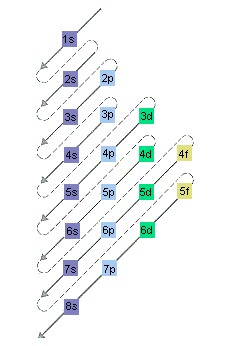 Seguendo la freccia scopriremo che l’orbitale 1s è quello a più bassa energia, poi avremo 2s, 2p, 3s, 3p…qui bisogna stare attenti perché invece degli orbitali 3d, come ci si aspetterebbe normalmente, c’è l’orbitale 4s.
Seguendo la freccia scopriremo che l’orbitale 1s è quello a più bassa energia, poi avremo 2s, 2p, 3s, 3p…qui bisogna stare attenti perché invece degli orbitali 3d, come ci si aspetterebbe normalmente, c’è l’orbitale 4s.
Insomma, seguendo questo schema si non ci saranno problemi a capire quali orbitali vengono prima degli altri nella scala energetica.
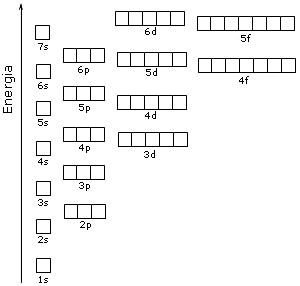
Un altro modo di rappresentare gli orbitali e che ci aiuterà nella costruzione della configurazione elettronica è mostrato nella figura seguente.
Adesso disponiamo di tutti gli strumenti per la costruzione della configurazione elettronica quindi procediamo con degli esempi.
Partiamo dall’elemento più semplice, l’idrogeno (H), che ha un solo elettrone quindi si andrà a posizionare nell’orbitale 1s; lo si può rappresentare graficamente così:
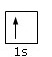 oppure come viene indicato nella tavola periodica: 1s1
oppure come viene indicato nella tavola periodica: 1s1
Passiamo ad un esempio un po’ più complesso, scriveremo la configurazione elettronica dell’azoto.
L’azoto ha 7 elettroni:
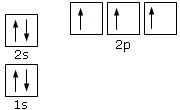 i primi due si andranno a posizionare con spin opposto, per la legge di esclusione di Pauli, nell’orbitale 1s quello a più bassa energia. Gli altri due, sempre con spin opposto, nell’orbitale 2s, che è quello successivo nella scala energetica. Gli ultimi tre andranno ad occupare tutti gli orbitali degeneri p secondo la regola di Hund. La configurazione elettronica dell’azoto sarà : 1s22s22p3
i primi due si andranno a posizionare con spin opposto, per la legge di esclusione di Pauli, nell’orbitale 1s quello a più bassa energia. Gli altri due, sempre con spin opposto, nell’orbitale 2s, che è quello successivo nella scala energetica. Gli ultimi tre andranno ad occupare tutti gli orbitali degeneri p secondo la regola di Hund. La configurazione elettronica dell’azoto sarà : 1s22s22p3
Altro esempio con l’ossigeno.
L’ossigeno ha 8 elettroni.
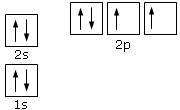 Come per l’azoto i primi 4 elettroni occuperanno gli orbitali a più bassa energia 1s 2s. Gli ultimi quattro elettroni si sistemeranno negli orbitali p: prima occupando tutti gli orbitali degeneri e poi, non avendo altro spazio a disposizione alla stesa energia, l’ultimo elettrone è costretto ad accoppiarsi. La configurazione dell’ossigeno sarà quindi: 1s22s22p4.
Come per l’azoto i primi 4 elettroni occuperanno gli orbitali a più bassa energia 1s 2s. Gli ultimi quattro elettroni si sistemeranno negli orbitali p: prima occupando tutti gli orbitali degeneri e poi, non avendo altro spazio a disposizione alla stesa energia, l’ultimo elettrone è costretto ad accoppiarsi. La configurazione dell’ossigeno sarà quindi: 1s22s22p4.
Se volete essere sempre aggiornati su tutto ciò che concerne il blog basta un “mi piace” alla fanpage. Vi aspetto numerosi!
[banner]
Immagini: www.treccani.it http://www.chimica-online.it