Lezione 5: i legami chimici – con questa lezione introduttiva entriamo nel vivo della chimica. Se non esistessero i legami non esisterebbe la materia come noi la conosciamo, anzi non esisterebbe niente!
Lezione 5: i legami chimici – con questa lezione introduttiva entriamo nel vivo della chimica. Se non esistessero i legami non esisterebbe la materia come noi la conosciamo, anzi non esisterebbe niente!
I legami tra atomi coinvolgono gli elettroni, ed in particolare quelli del livello più esterno. Ci si potrebbe chiedere come mai gli elettroni degli atomi che formano il legame non si respingano, dato che sono cariche dello stesso segno. Vi dirò di più, anche i nuclei degli atomi che vanno a legarsi si respingono. La risposta a questa domanda è semplice: le forze repulsive tra elettroni-elettroni e nucleo-nucleo di due atomi che si legano risultano inferiori alle forze attrattive tra elettroni di un atomo e nucleo dell’altro atomo.
Il legame avviene solo se il bilancio energetico è favorevole, quindi la formazione di un legame avviene con rilascio di energia che è esattamente uguale all’energia che si deve impiegare per spezzare quello stesso legame e si chiama energia di legame.
Abbiamo capito che due atomi possono legarsi tra loro, ma come realizzano questi legami? Oltre alla regola della maggiore stabilità (minore contenuto energetico) quali regole seguono?
Ci viene in aiuto la famosissima regola dell’ottetto: un atomo è stabile quando ha otto elettroni nel suo livello più esterno, se un atomo non è stabile (non ha otto elettroni nel suo livello più esterno) tende ad acquisire la stabilità legandosi ad altri atomi cedendo o acquistando, o mettendo in comune un adeguato numero di elettroni.
Ciò venne scoperto grazie ai gas “nobili” che rifiutano di legarsi con qualsiasi altro atomo proprio perché hanno otto elettroni nel livello più esterno. Per intenderci i gas nobili sono quelli del gruppo VIIIA (estrema destra della tavola periodica):Elio, Neon, Argon etc.
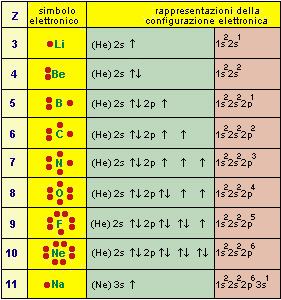
A questo punto abbiamo capito che gli elettroni che partecipano attivamente al legame sono quelli del livello più esterno chiamati anche elettroni di valenza. Per comprendere meglio come vengono instaurati i legami è utile prendere in considerazione i cosiddetti simboli di Lewis formati dai simboli degli atomi circondati da tanti puntini quanti sono i suoi elettroni di valenza.
Nella tabella seguente vengono riportati alcuni atomi rappresentati con i simboli di Lewis seguiti dalla rappresentazione grafica della configurazione elettronica.
Se volete essere sempre aggiornati su tutto ciò che concerne il blog basta un “mi piace” alla fanpage. Vi aspetto numerosi!